口服固体制剂已有四批品种通过一致性评价,才进入收获期,注射剂随即赶到!
5月28日,海南普利制药发出公告称:公司收到了CFDA签发的注射用阿奇霉素通过仿制药质量与疗效一致性评价的《药品补充申请批件》(批件号 2018B02894)。
消息来得不算突然,因为该品的CDE审评受理号CYHB1706743已于5月24日更新了状态-已发件。
值得琢磨的是,本品是怎么率先通过一致性评价的呢?注射剂通过一致性评价有什么“招数”?
1、国内外共生产线上市
注射用阿奇霉素
关注点:过度重复品种仍有突围机会,有望后来居上
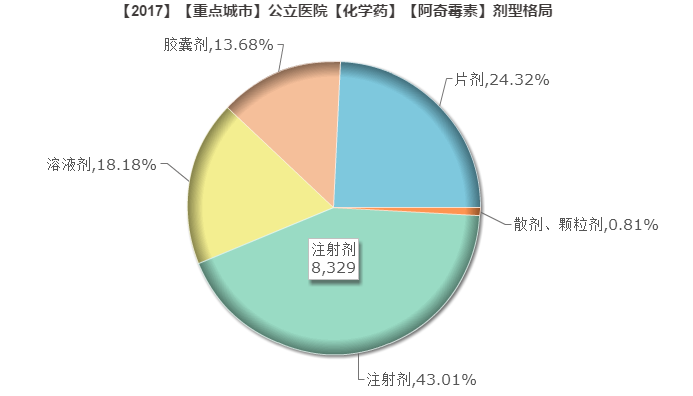
注射用阿奇霉素属于抗生素,适用于敏感病原菌所致的社区获得性肺炎和盆腔炎性疾病。
注射用阿奇霉素,国产药有132个批文64家生产企业,进口药有5个批文2家生产企业,属于过度重复品种。
据重点城市公立医院实际数据,2017年前三季度注射用阿奇霉素销售8329万元。其中东北制药沈阳第一制药占阿奇霉素注射剂型市场份额72%,辉瑞占26%,峨眉山通惠制药占1.9%。
海南普利制药的注射剂阿奇霉素(0.5g)属于新晋竞争者,是同步申请中国和美国注册的双报品种,于2015年10月获得FDA的暂时性批准。随后于2016 年 9 月获得CDE的优先审评审批资格,于 2017年 8 月以“化学药品旧注册分类6类”获得CFDA批准上市。
根据,总局关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号),文中提到:在中国境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品,经一致性评价办公室审核批准视同通过一致性评价。
于是普利制药再提交了补充申请CYHB1706743,如今以通过一致性评价的身份国内上市,有望获得区别于国内其他企业的质量层次,将对其他生产企业形成压力。
这“出口转内销型”过一致性评价的路径,已有不少成功的案例,典型的“弯道超车”,是CFDA政策红利的准时兑现。
上周,CFDA发布了第4批通过一致性评价的12个药品名单,同时发布的《关于“通过一致性评价”标识使用有关事宜的说明》文件,特别指出:凡纳入与原研药可相互替代药品目录即《中国上市药品目录集》的仿制药可使用“通过一致性评价”标识。
这是CFDA首次正式表态:按化学药物新注册分类批准的仿制药允许使用“通过一致性评价”标识。
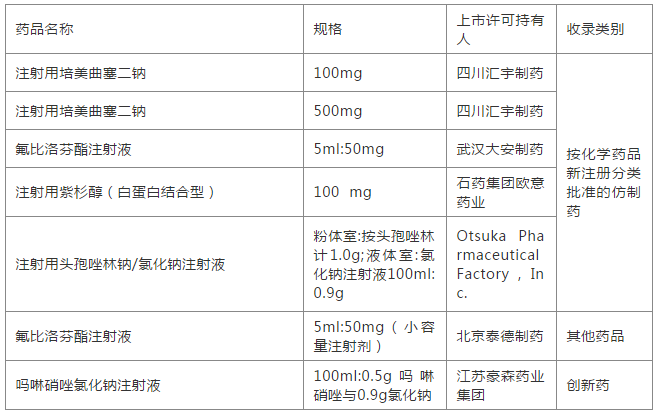
被赋予“中国橙皮书”色彩的《中国上市药品目录集》,查询“注射剂”结果:有5个注射剂是以“按化学药物新注册分类批准的仿制药”被收录,有1个注射剂是以“创新药”被收录,另有1个注射剂以“其他药品”被收录。
2、按化药“新注册分类”申请上市
注射用培美曲塞二钠
关注点:一鸣惊人,实力不可低估
注射用培美曲塞二钠属于抗肿瘤药,适用于与顺铂联合治疗无法手术的恶性胸膜间皮瘤。
国产企业有15家(28个批文),进口企业1家(2个批文)。
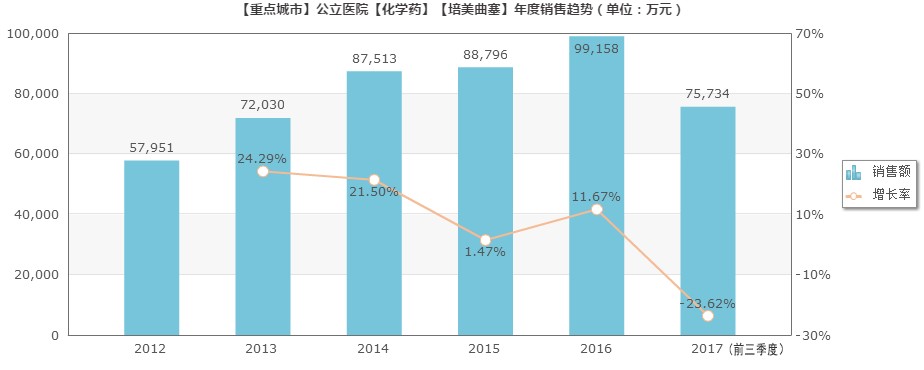
据重点城市公立医院数据,2017年前三季度注射用培美曲塞二钠销售7.57亿元。
豪森(39.38%)、齐鲁(30.61%)和礼来(17.05%)占据八成以上的市场份额,剩余的12家企业份额零散。
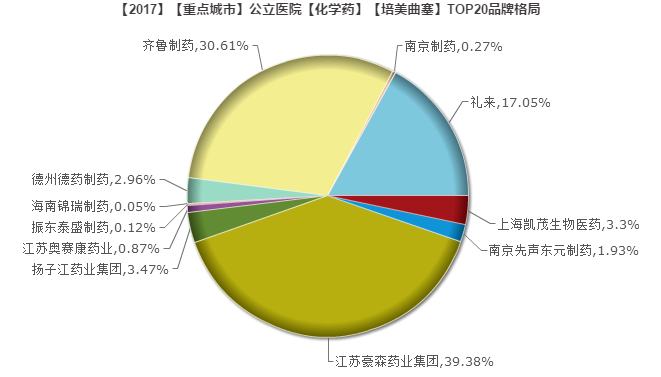
尚未上榜的四川汇宇是按照新注册分类申报,并以“已在欧盟递交注册申请,获得英国MHRA GMP认证”理由获得优先审评,批准上市后就被收录到《中国上市药品目录集》。
四川汇宇成为该品首家通过一致性评价的企业,未来市场前景一片光明。
注射用紫杉醇(白蛋白结合型)
关注点:10亿重磅潜力产品
紫杉醇属于抗肿瘤药,适用于治疗联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌。
国产企业和进口企业各有1家。
曾经石药集团和恒瑞在本品上争夺首仿,最后石药集团欧意药业以“新注册分类4类”于今年2月份获批成为首仿药,也顺利通过了一致性评价。预计恒瑞将成为第2家上市白蛋白紫杉醇的厂家。
据重点城市公立医院数据,2017年前三季度本品费森尤斯卡比的销售为1.47亿元。本品也被认为具有10亿潜质的重磅产品。
3、老实撤回、按一致性标准重新申报
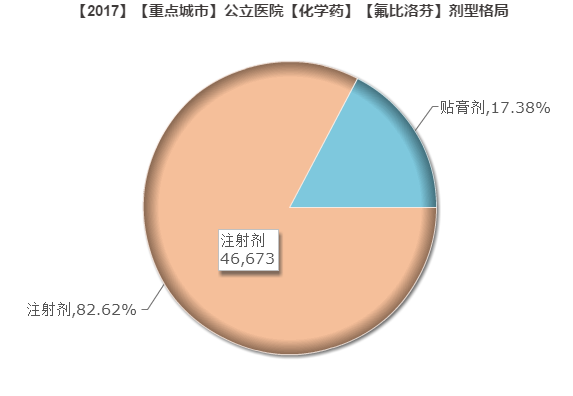
氟比洛芬酯注射液
关注点:市场大,趁竞争者还未进场
氟比洛芬酯注射液属于解热镇痛和其他镇痛药,用于术后及癌症的镇痛。
本品由日本科研制药株式会社开发,2004年由北京泰德制药引进,在国内独家上市。武汉大安制药于2011年提交氟比洛芬酯注射液上市申请,于2015年主动撤回申请,随后按质量和疗效一致性重新提交申请,被纳入优先审评程序,今年3月份获批上市。目前国内只有这两家生产企业。
据重点城市公立医院数据,2017年前三季度氟比洛芬销售5.65亿元。注射剂超80%份额,全属于北京泰德制药的市场。现武汉大安制药入场,有望能从泰德制药手里拿走部分份额。
两家药企同时通过一致性评价,第三家企业仍有悬念。常州四药制药以“新注册分类3类”申请上市,在审评审批中;另有3家企业,正在进行BE试验。预计短期内,本品难有新的竞争者进入,市场格局不会有太大变化。
4、特殊途径
吗啉硝唑氯化钠注射液
关注点:国内创新药
吗啉硝唑属于全身用抗细菌药,仅限用于治疗或预防已被证实或疑似易感病原体导致的感染。
吗啉硝唑氯化钠注射液是江苏豪森独家品种,商品名“迈灵达”,2014年获CFDA批准上市,是该品的参比制剂。该品是唯一一个以“国内创新药”收录到《中国上市药品目录集》的注射剂。
本品于2017年7月被纳入《国家医保目录2017版》乙类范围,并确定了支付标准为106元,限二线用药。对于新药来说,医保目录对新产品研发和销售有着非常强的引导作用,能纳入医保目录才能在市场发热发亮。预计本品今年的销售会有明显的提升。
注射用头孢唑林钠/氯化钠注射液
关注点:暂无国产企业
本品为即配型粉-液双室袋注射剂,属于全身用抗细菌药,适用于治疗敏感细菌所致的支气管炎及肺炎等呼吸道感染、尿路感染、皮肤 软组织感染、骨和关节感染、败血症、感染性心内膜炎、肝胆系统感染及 眼、耳、鼻、喉科等感染。
国内只有1家进口企业:日本大冢制药。
据重点城市公立医院数据,暂无本品销售信息。
除了上述途径,当然还能扎扎实实、一步一步按规定与原研药做质量与疗效对比,或者评估相关技术要求,提出免于参加一致性评价的申请。
不过,鉴于仿制药注射剂一致性评价政策实行还有一段时间并且也会比较漫长,新报的注射剂更有可能成为最早通过一致性评价的品种。



