据小编整理及统计,上周(11.2~11.10)共有17个品种通过一致性评价,其中6个品种首家过评,创造了周过评品种数量的新记录。
某种程度上说,一致性评价的战场,已经进入白热化阶段。
上周一致性评价过评情况
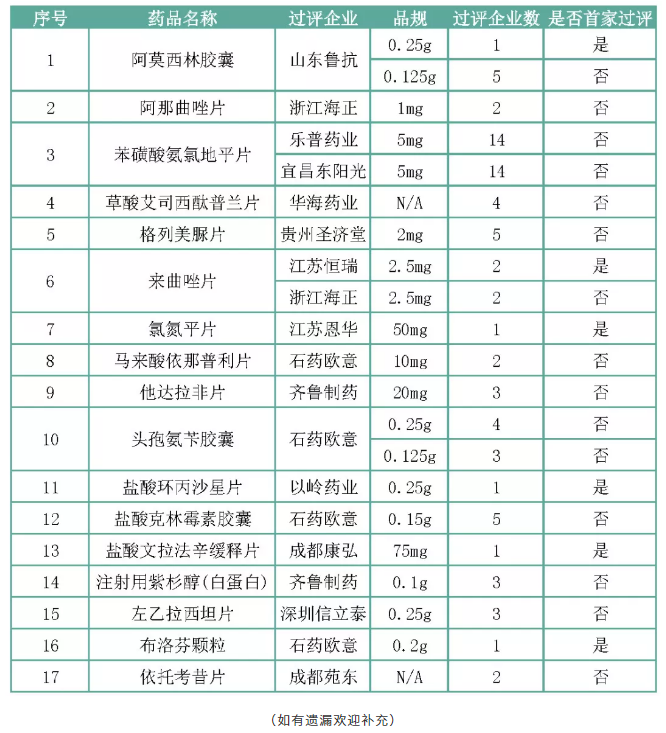
上周最大的赢家无疑是石药欧意,过评涉及4个品种5个品规(马来酸依那普利片、头孢氨苄胶囊、盐酸克林霉素胶囊、布洛芬颗粒),其中布洛芬颗粒(0.2g)为首家过评。
齐鲁制药(注射用紫杉醇-白蛋白结合型、他达拉非片)和浙江海正(阿那曲唑片、来曲唑片)均有两个品种通过一致性评价;山东鲁抗(阿莫西林胶囊)一品种两个品规(0.125g、0.25g)同时过评。值得注意的是来曲唑片,浙江海正仅比江苏恒瑞晚一步,成为第二家过评企业。
在这扎堆过评的品种中,有6个品种为首家过评,分别是:
l 阿莫西林胶囊-山东鲁抗
l 来曲唑片-江苏恒瑞
l 氯氮平片-江苏恩华
l 盐酸环丙沙星片-以岭药业
l 盐酸文拉法辛缓释片-成都康弘
l 布洛芬颗粒-石药欧意
来曲唑片:
是一种选择性、非甾体类芳香化酶抑制剂,主要用于以下适应症:
1.对绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性;
2.对已经接受他莫昔芬辅助治疗5年的、绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性;
3.治疗绝经后、雌激素受体阳性、孕激素受体阳性或受体状况不明的晚期乳腺癌患者,这些患者应为自然绝经或人工诱导绝经。
来曲唑由诺华制药研发,1996年12月首次在欧盟获批上市,商品名为Femara®,规格为2.5mg,适应症为对绝经后早期乳腺癌患者的辅助治疗。
1999 年7月在美国获批上市,2006年1月在日本获批上市。2001年4月,诺华制药的来曲唑片首次在中国获批,用于绝经后早期乳腺癌患者辅助治疗。2013年5月,江苏恒瑞生产的来曲唑片通过美国FDA认证,获准在美国市场销售。
除诺华制药研发的来曲唑片外,国内仅有江苏恒瑞及浙江海正获批上市。江苏恒瑞为首家过评企业,浙江海正紧随其后,同一天内成为第二家过评企业。
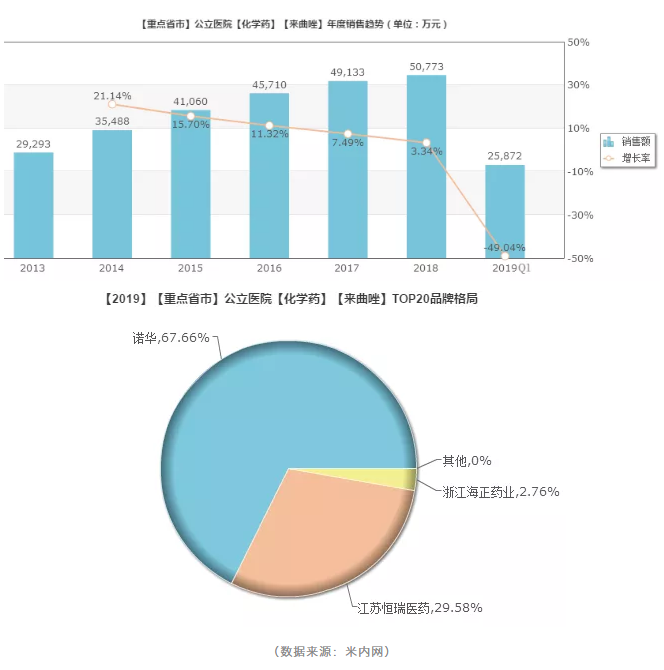
据米内数据库统计,来曲唑销售额稳步上升,2018年有5.08亿元人民币的销售收入;2019年第一季度为2.59亿元人民币【国内重点省市公立医院】。原研诺华市场占比67.66%;江苏恒瑞29.58%;浙江海正2.76%。
盐酸文拉法辛缓释片:
是一种选择性5-羟色胺(5-HT)和去甲肾上腺素(NE)再摄取抑制剂(SNRI),适用于各种类型的抑郁症及广泛性焦虑症。
1994年文拉法辛在美国上市,原研为辉瑞。1998年康弘药业的盐酸文拉法辛胶囊(商品名:博乐欣)在国内上市,先于原研产品,成为国内第一款文拉法辛产品。
2007年,康弘药业博乐欣升级为缓释片剂型,再次领先于原研产品,成为国内第一个上市的文拉法辛缓释制剂。
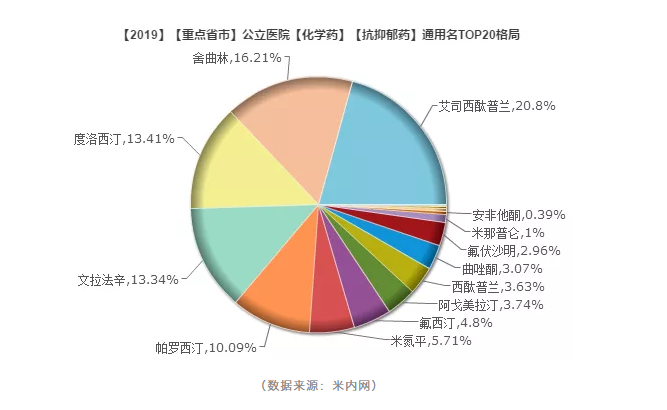
据统计,2018年中国公立医疗机构终端抗抑郁药市场规模已至81.28亿元,同比增长19.13%。在抗抑郁药通用名TOP20中,文拉法辛以13.34%占比排名第四。
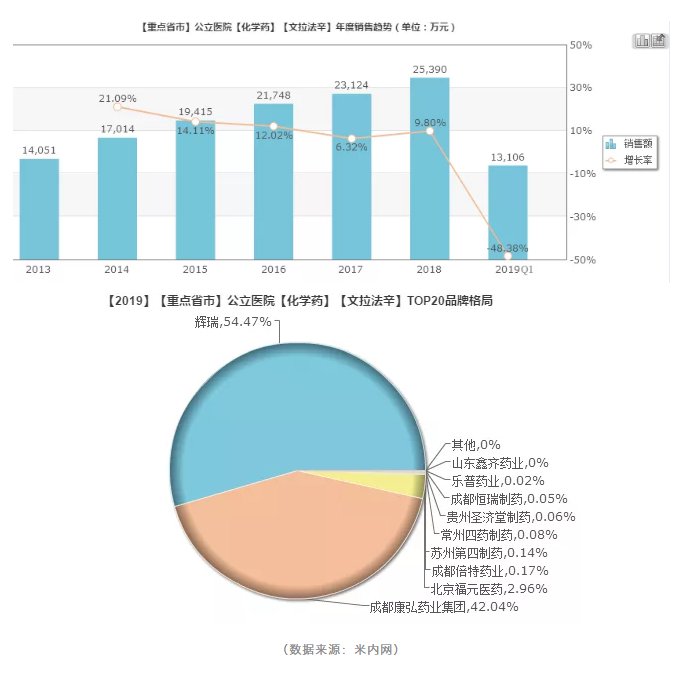
面对高速增长的抗抑郁药市场,文拉法辛在近几年均呈现逐步增长的态势。2018年国内重点省市公立医院销售数据2.54亿元人民币,同比增长9.8%;2019年第一季度1.31亿元人民币,本年将有望突破5亿元人民币,销售收入翻一番。
市场占比:辉瑞54.47%;成都康弘42.04%;北京福元、成都倍特、苏州第四制药等7家药企共占3.49%。
康弘药业的博乐欣是目前市场上首个通过一致性评价的文拉法辛缓释制剂。而国药集团以仿制药“新3类”申报盐酸文拉法辛缓释片,获批即视同通过一致性评价,成为该品种首仿企业。
该品种已进入2018年版国家基药目录、国家医保甲类目录,成为中国医生临床治疗需求的一线选择!



