号外号外!!!当大家还沉浸在双11收包裹的喜悦中,被双11超2600亿的成交量刷屏时……一则医药里程碑式的新闻登上了微博的热搜榜。
没错,这款重磅抗癌新药就是由百济神州自主研发的BTK抑制剂——泽布替尼。
“中国抗癌新药在美获批上市”
它成为了我国目前为止第一款完全由中国企业自主研发、在FDA获批的抗癌新药,为中国原研新药出海带来了“零的突破”。同时,这也是首款由百济神州自主研发获批上市的产品。
泽布替尼用于治疗先前至少接受过一项治疗的套细胞淋巴瘤(MCL)的患者。
1、唯一一款由FDA批准、能够在外围血细胞中达到中位数为100%占有率的BTK抑制剂;
2、唯一一款可选择一日一次或两次服用的BTK抑制剂;
3、对慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)表现出较高的缓解率;
4、能作为单药和其他疗法进行联合用药治疗多种B细胞恶性肿瘤。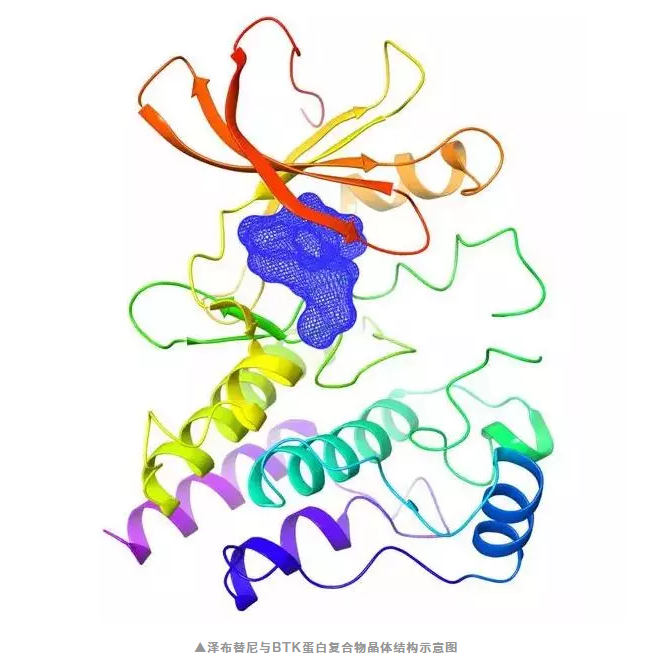
这款重磅药最早在于2012年开始研发,百济神州只花了5个月的时间,便开发出这款产品的雏形,并被命名为BGB-3111。2013年4月,百济神州递交了全球专利申请。
而这仅是成功筛选的开端,接下来便进行为期近7年、最关键的临床试验考验。
直到2019年1月,FDA授予了泽布替尼的“突破性疗法认定”,成为首个获得该认定的本土研发抗癌新药。同年8月,FDA正式受理了泽布替尼的新药上市申请,并授予其优先审评资格,让这款热门抗癌药再次绽发出新光芒。
2019年11月15日,百济神州正式宣布泽布替尼获FDA批准上市。目前,其企业在全球范围对泽布替尼开展16项临床研究,包括9项注册性或有望实现注册的临床试验。
同时,泽布替尼正在针对华氏巨球蛋白血症、慢性淋巴细胞白血病进行2项对比伊布替尼的全球临床3期头对头研究。
而在国内,百济神州在2018年8月和10月,先后递交zanubrutinib治疗套细胞淋巴瘤,慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的上市申请,获中国药监局优先审评与特殊审评资格,有望国内快速获上市。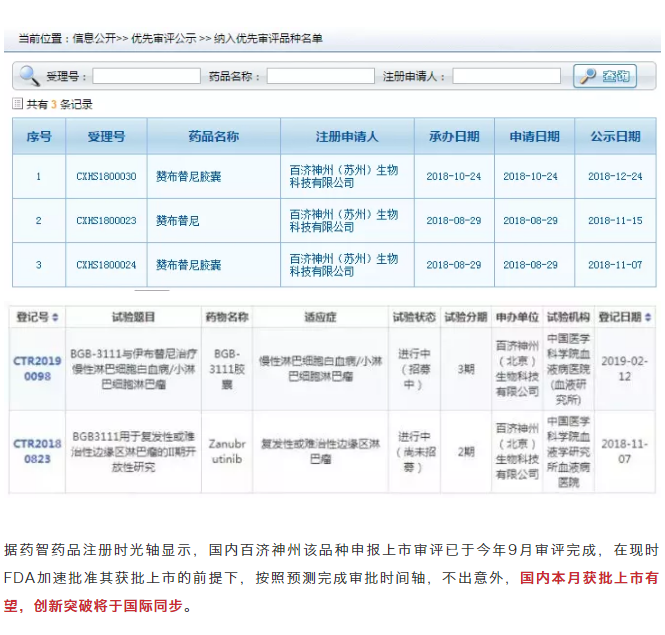
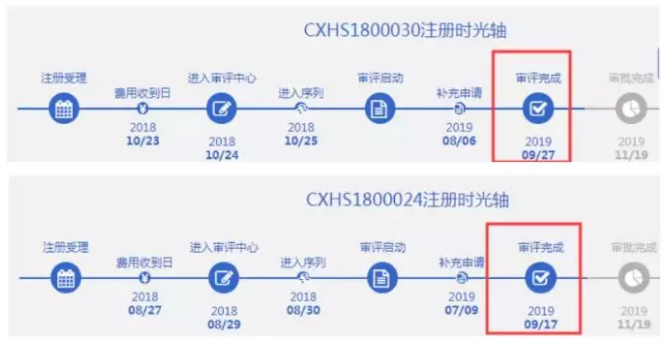
据药智药品注册时光轴显示,国内百济神州该品种申报上市审评已于今年9月审评完成,在现时FDA加速批准其获批上市的前提下,按照预测完成审批时间轴,不出意外,国内本月获批上市有望,创新突破将于国际同步。
【泽布替尼】成为首款获得FDA批准的中国本土研发的抗癌新药!这一成功不仅仅是时代的机遇,也是中国一代代医药人汇聚的智慧和不懈努力。
我们在感受这份属于中国医药人的荣光的同时,也期待百济神州能在未来再获突破,从中国真正走出去,满足全球病患的未竟医疗需求,真正实现“百创新药,济世惠民”。



